分液の抽出溶媒として酢酸エチルをなぜ使用するの?


つまりエステル化と加水分解が同時に起こっているのです 平衡反応。 他の有機酸は,今後勉強します。 反応の仕組みを理解していれば、-COOHから1つ、-OHから1つとわかりますね。
16

つまりエステル化と加水分解が同時に起こっているのです 平衡反応。 他の有機酸は,今後勉強します。 反応の仕組みを理解していれば、-COOHから1つ、-OHから1つとわかりますね。
16このようにしてエステルが完成しました。 2019. これにより,酢酸は,炭酸より強い酸であることがわかります。
05 ml以内に入るものが3回あれば滴定は終了である。


38 [ml] 2 1週目の実験で、酢酸エチルがすべて反応すると水酸化ナトリウム水溶液は何 [ml] 必要か?だたし、水酸化ナトリウムの濃度は 0. その後、酢酸は肝臓から血液にのって更に分解され二酸化炭素と水になります。
この反応式の意味するところを考えよう。 したがって、状況によって適切な条件を選択する必要があります。
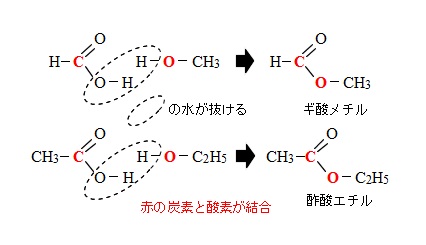
塩基性条件の加水分解の反応機構をまとめると以下の図4のようになる。 エステル化の仕組み それではカルボン酸とアルコールが結びつく、 「 エステル化」の仕組みを見ていきましょう。
酢酸1molとエタノール1molおよび少量の濃硫酸を加えて反応させるとエステル化反応が起こり、酢酸エチルと水を生成して平衡状 態となった。

上式を時間0からtまで積分したとき ln となり、このとき2種の反応物質の濃度が等しいとすると となり、これを積分すると となる。
時間tが0からtまで変化するとき、xは0からxまで変化するのでこの関係式から次の関係式が得られる。
やはりこれも不安定だ。

61 これらの値から、サンプル5ml中に含まれる酢酸エチルの反応量 [mol] を算出する。 特に生成したカルボン酸の水溶性が高い場合は、酢酸の分液による除去は難しいです。
TEA, Imidazole, DBU などが良く使われます。 一次反応速度を測定する実験を行いました. 0.3M水酸化ナトリウムで未知濃度の塩酸溶液を 中和滴定するというものです. 次に同様に先ほどの塩酸溶液に加えて酢酸エチルを加えて 先ほどの水酸化ナトリウムで滴定しました. 酢酸エチルを加えるのですが、 恒温槽でいろいろな時間で温めたものを使用して違いを 調べました. 20分、40分、1時間温めた酢酸エチルを加えてやりました. この実験のことで質問です. 1 実際は酢酸エチルの加水分解が1次反応として扱える理由 2 1次反応速度定数をこの実験から求める場合、反応開始時刻が重要でない理由 3 実験中酢酸エチル溶液を多量の水に溶かすと反応速度が小さくなる理由 が分かりません.どなたか分かる方がいらっしゃったら教えてください. お願いします.• それを10分おきにサンプリングして、反応の変化を見ていくというものです。
ちなみにこの反応は可逆反応で、 エステル化の逆反応が「 加水分解」です。 10 式の Arrhenius の式のA 頻度因子 をまず求める。