希薄溶液の束一的性質


過冷却をできるだけ防ぐためには、時間をかけてゆっくり冷やすか、結晶核を加えるか、ちょっと振動させて核ができやすくすることです。
7これによって、蒸気圧降下が起こるのです。 撹拌が十分でなければ,場所によって温度が違うことが考えられますが,温度計の機器誤差が最も大きな原因でしょう。


溶液は蒸気圧降下により純溶媒よりも蒸気圧が低くなるため,沸騰させる(蒸気圧=大気圧にする)のに純溶媒よりも熱を加えなければならず,これを〔 沸点上昇 〕という。
温度を下げようと周囲から冷却をしても、すぐに凝固熱が生じて温度が上昇します。
図3 3. このような現象のことを、 蒸気圧降下という。
<溶液の凝固点の測定> 6 平底試験管を取り出し,水道水をかけて凝固した蒸留水を融かす。 温度が下がると融解速度は小さくなる。


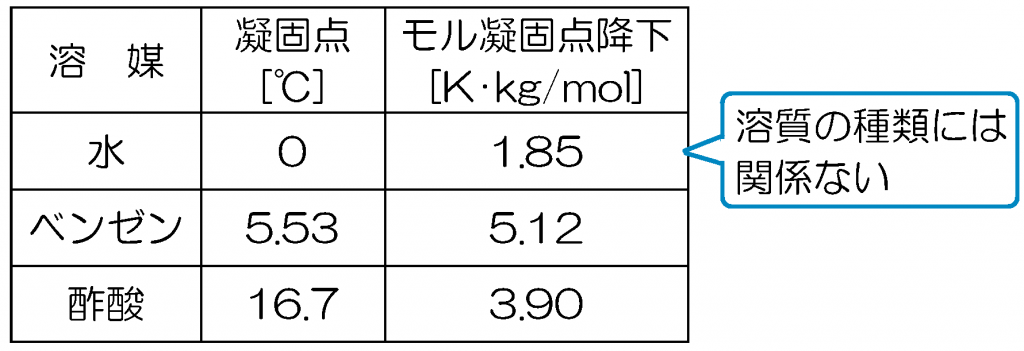
溶液の浸透圧は溶質の種類に関係なく,溶けている溶質粒子(分子 ,イオンなど)のモル濃度(質量モル濃度ではない)に比例し,絶対温度に比例する。 01 mol の塩化ナトリウム NaCl を溶かし、 - 0. このときのグルコース水溶液の凝固点を求めよ。
これより、 - 0. 以下に詳しい解答解説を載せているので、 分からなかった部分があればじっくり読んでみて下さい。

<図5> この様に、純粋溶媒に溶質分子を混ぜる事で沸騰する温度が本来の温度以上になる事を「沸点上昇」、凝固する温度が本来よりも下がる事を「凝固点降下」と言います。
12元の水溶 液の質量を M kg 、水のモル凝固点降下を K f として、この温度で何gの氷が生じているか答えよ。
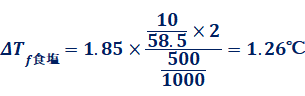

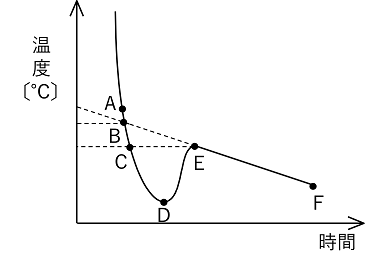
まず、過冷却から凝固が始まってからも徐々に温度が下がっているところに目を引かれますよね。 溶質がスクロースからエタノールなど別の物質になってもその度合いは変わらない。 ここで、状態変化における融解熱が、吸熱反応であったことを思い出してください。
溶質は凝固しませんので、液体側は溶質が存在する分だけ凝固速度が遅くなります。

1 B 2 100. 冷却曲線 例えばベンゼンを試験管に入れ、周りを氷水で均一になるようにかき混ぜながら冷やす冷却装置と温度計をセットした器具を用いて一定時間ごとの温度を測定します。
12(グラフのD以降) 溶液の冷却曲線の直線部分について 溶液が凝固するときは溶媒だけが先に凝固します。

。 そして、2 つで 1 つの分子になるということは、分子量が 2 倍になるという事です。 つまり、溶液中では、溶質粒子と溶媒粒子が無秩序に混じり合っているために、純溶媒中の溶媒分子よりも乱雑さが大きくなり、溶液は熱力学的に安定化しているといえます。
9理屈がわかれば、沸点上昇と凝固点降下の計算はそれほど難しく有りません。