酸化と還元|酸化数から酸化還元反応を考えよう

したがって、 酸化数は-2となります。 こいつのOの酸化数を求めたいとしよう。 化合物は異なる原子同士が結合してできており、原子の電気陰性度には当然差がある。
5

したがって、 酸化数は-2となります。 こいつのOの酸化数を求めたいとしよう。 化合物は異なる原子同士が結合してできており、原子の電気陰性度には当然差がある。
5このように2つのルールを考慮して各元素の酸化数を決定します。 7 ハロゲンの酸化数 ハロゲンは電気陰性度が大きいため、共有電子対を引き付けます。
以下の化合物もしくはイオンにおいて、カッコ内の元素の酸化数を答えよ。 水素が他の原子と違うのは、その価電子が1個しかないことです。 12 緩衝液は一見難しく感じますよね。
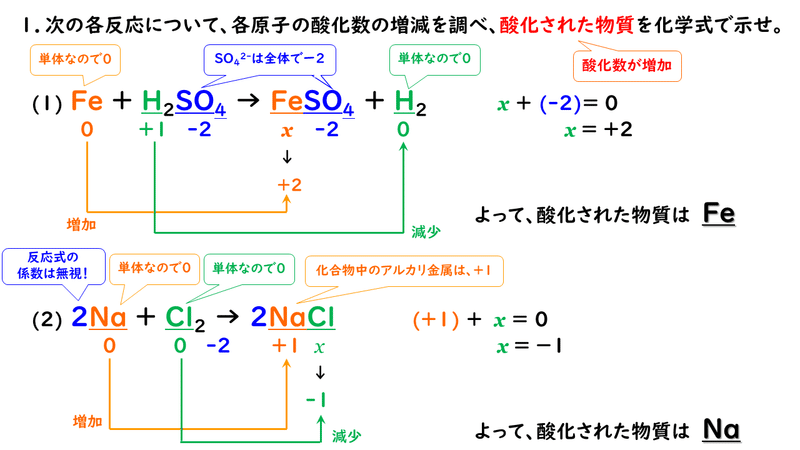
1「単原子イオンの酸化数はイオンの荷数に等しい」 というのは酸化数の一番最初に出てきていたのではありませんか。 (1)CO 2 C (2)NaHSO 4 S (3)MnO 4 — Mn (4)H 2O 2 O (5)HClO Cl 一緒に解いてみましょう。
酸化数はそういう意味ではこじつけの数字です。
つまり、沸点というのは飽和蒸気圧が大気圧と同じになる温度のことを言います。 そのため、 酸化数は+1となります。
基本的なのはすぐ解けるのですが、 2MnSO4 みたいなもの。
逆に還元状態にある場合には負の数値をとり、その値が大きいほど電子過剰の状態にあることを示す。


酸化剤・還元剤 自分自身が還元されることにより、相手を酸化する物質のことを 酸化剤といいます。
緩衝液にたどり[…]• この反応を表す式は次のようになります。
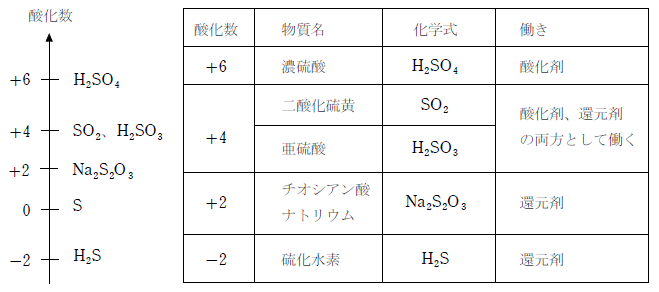
ここでは、酸化数という考え方を説明します。 練習問題で酸化数を求めた、 過マンガン酸イオンMnO 4 —で考えてみましょう(硫酸酸性下で考えます)。

ここで、酸素の半反応式は3. 電気陰性度の大きい原子というのは、事実上、F,O,Nと考えて良いでしょう。 多原子イオンの酸化数 多原子イオンの酸化数については単原子イオンの酸化数と同様の考え方をすればいい。 暗記するべき問題 上のルールを見てわかるように、「金属の水素化物」と「過酸化物」は特別である。
実は、H=+1 と教えられていますが、 NaH(水素化ナトリウム)のような化合物ではH=-1になります。